01、概述
近年来,全球医药行业的竞争日趋激烈,制药产业链中的分工日益细化,医药行业的专业化外包已成为制药企业的重要战略选择。随着医药外包服务机构专业化程度的不断提高,医药外包服务的内容逐渐涵盖了从疾病目标研究、药物化合物筛选、临床试验服务、工艺研发、规模化生产直至市场销售的各环节。
02、CRO、CMO、CDMO
2.1 CRO
随着新药研发成本的日益增长,许多跨国制药公司开始剥离研发中的非核心部分,逐渐催生出了一个庞大的全球研发外包市场——合同研究组织(CRO)。CRO企业即合同定制研发机构,是指通过合同形式为制药企业和研发机构在药物研发过程中提供专业化服务的机构。CRO提供包括新药产品开发、临床前试验及临床试验、数据管理、新药申请等多种技术服务,几乎涵盖了新药研发的整个过程。
其基本目的在于协助制药企业进行科学或医学研究,主要提供的服务包括新药发现、安全性评价研究服务、药代动力学、药理毒理学等临床前研究及临床数据管理、新药注册申请等。
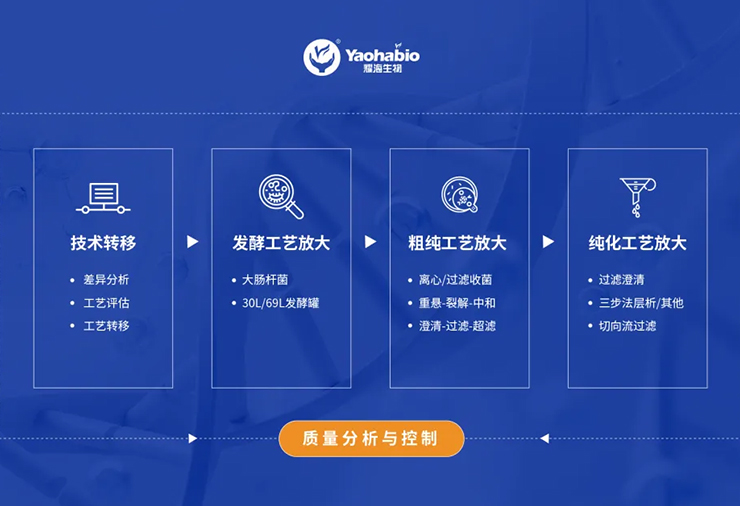
2.2 CMO
CMO(ContractIlanufacturing0rganization)即合同定制生产机构,是指以合同定制形式为制药企业提供中间体、原料药、制剂的生产以及包装等服务的企业。起源于20世纪80年代后期,由于当时全球经济后退,许多制药企业在强大的竞争压力下开始将非核心或不具优势的生产和销售业务进行外包,从而降低企业自身运营成本,增强企业竞争力。
传统的CMO企业仅提供以委托企业提供的技术路线为基础的代工生产服务。随着制药公司对成本控制和效率提升的要求不断提高,制药企业希望CMO 企业能够承担更多工艺研发、改进的创新性服务职能,CDMO企业应运而生。
2.3 CDMO
CDMO (ContractDevelopmentandManufacturingOrganization)企业即合同定制研发生产机构,除了提供传统CMO的生产服务之外,更强调对生产工艺的研发和创新。CDMO 企业往往在新药临床阶段的早期即与客户开展深度合作,为客户提供制药工艺的开发、设计及优化服务,并在此基础上提供从公斤级到吨级的定制生产服务。CDMO 企业利用自身技术优势及生产能力,承接了制药企业的工艺开发和生产职能,从而使制药企业可以更专注于药物的研发。
03、三者在药品设计与研发方面的差异
| 医药外包服务机构 | 在药品设计与研发方面提供的服务 | 服务具体内容 |
| CRO | 药物开发相关的 | 临床前 CRO 服务包括新药发现、安全性评价研究服务、药代动力学、药理毒理学、动物模型的构建等:临床 CRO 服务主要针对临床试验阶段的研究提供服务,涵盖临床 I-IV 期技术服务、临床数据管理和统计分析、新药注册申报等 |
| 科学或医学研究 | ||
| CMO | 不涉及实质性研发工作 | 根据客户提供的生产工艺直接进行代工生产,不涉及生产技术或工艺的实质性研发 |
| CDMO | 药物生产工艺的设计、研发 | 根据客户对目标化合物的技术与质量要求,开展工艺设计、工艺优化等服务,并在此基础上提供定制生产服务 |
04、CDMO服务与销售产品之间的关系
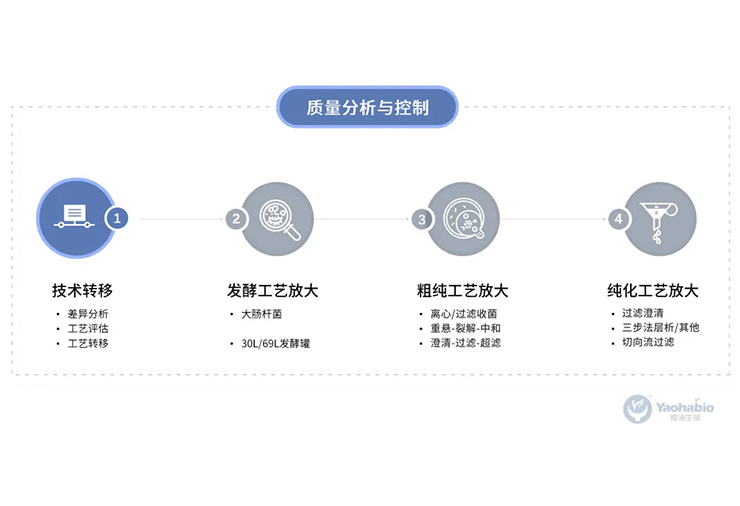
销售商品是公司CDMO服务成果的交付形态。药物研发是一项高风险、 高投入、长周期的系统性工程。制药企业客户为了降低药品研发成本,提高生产效率,将制药工艺研发和生产委托于公司定制开展。公司接受跨国制药企业委托为其提供的制药工艺研发和药物生产的服务过程即为CDMO服务。公司服务内容一般包括工艺设计、工艺放大、化学结构或组分确认,质量及稳定性研究、杂质研究、定制生产等多种研发和生产内容。工艺开发和生产过程完成后,公司将服务形成的中间体或原料药等商品交付给客户完成全部服务过程。具体而言, 发行人提供的CDMO服务与销售产品之间关系如下:
(1)CDMO服务是商品形成的业务过程
公司为客户提供的 CDMO 服务的主要目标是按照客户要求成功研发出具备商业化生产可行性的医药中间体或原料药等产品。CDMO服务是产品得以形成的过程。
(2)CDMO服务是满足客户定制需求的必要条件
不同于大多数通用产品取得订单便可以组织实施生产,医药定制产品是专业性程度强、定制化程度高的特殊产品。公司在开展定制研发和定制生产过程中,必须时刻知悉定制客户的特定需求通过反复多次的技术交流,确定产品的各项技术细节。制药企业客户期望通过委托合作取得的定制化商品,只有通过CDMO的详细服务过程,才能得以实现,CDMO 服务过程是定制化商品形成的必要条件。
(3)终端客户通过质量审计等合作程序参与公司提供的 CDMO 服务
由于医药行业的特殊性,医药行业的定制研发生产与普通合同委托有大的差别。终端客户将药物研发生产环节委托给公司定制开展,对药品及其中间体的安全、有效和质量都极其关注,仅依据交付的商品无法对药品生产过程进行全面有效判断。
(4)公司 CDMO 服务内容及成果交付形态与同行业可比上市公司的 CDMO 服务内容及成果交付形态基本一致

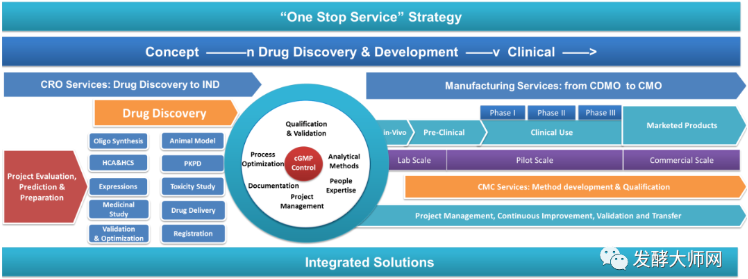
凭借多年在微生物表达体系领域的实践经验积累,耀海生物坚持以“创新研发、平台构建、产能提升、合规保障”等多维度的不断发展,目前公司已搭建成熟的多肽、蛋白质药物一站式CRDMO服务平台,业务涵盖“重组蛋白/多肽、核酸药物、纳米抗体、新型重组疫苗和重组质粒”等方向,成功交付两百余个项目,贯穿早期研究、IND新药临床申报、临床样品GMP生产和商业化生产的全生命周期。
不论在技术研发创新还是生产产能布局,耀海生物在国内均位于领先。通过创新的工艺技术平台、科学规范的服务体系及丰富的项目实践经验,能够为广大合作伙伴提供端到端的、一站式CRDMO整体解决方案。
1. 丰富的项目经验
• 经过多年深耕,公司已经搭建了行业内领先的一站式CRO/CDMO/MAH开放式服务平台。截止目前,公司已成功交付两百余个项目,包括3个Ⅲ期临床项目,4个Ⅱ期临床项目,多个IND及Ⅰ期临床项目,其中7个中美双报,2个澳洲注册项目,服务项目涉及多种类型主流生物药物及广泛的适应症,满足全球多地注册申报,积累了丰富的项目经验和服务能力。
2. 端到端、一站式的CRDMO服务能力
• 公司坚持以创新驱动技术、技术驱动服务的战略定位,以专业纯粹、高效优质的一站式CRDMO服务平台,致力于为客户提供从基因工程菌构建、菌种库建立、小试工艺开发优化、中试工艺放大生产、IND申报和临床样品制备、质量标准建立、分析方法开发验证、合规化生产(GMP)、质量管理体系建立、注册申报等全生命周期的CRDMO服务。
3. 专业稳定的项目团队保障
• 公司拥有经验丰富的CRDMO执行团队,匹配专业人才梯队,具备深厚的生物制品全生命周期服务经验,能够快速响应、灵活应对不同项目类型,高效协同助推项目委托服务,确保所有项目高质量及时交付。
4. 全面的产能保障(高产能&高灵活性)
• 公司在泰州建有符合GMP的规模化生产服务基地,配备多条完整的上下游产线,可提供50L-100L、200L、500L、1000L及2000L等规模的原液CDMO服务,发酵总规模达7500L;两条制剂产线,覆盖西林瓶水针/冻干、预充针/卡式瓶等剂型,年产量超1000万支。高质量的产能布局,能够为广大生物制药企业提供更广维度的全流程服务。
5. 卓越的合规服务保障体系
• 公司已全面构建专业化、标准化、规范化的服务保障体系,确保全生命周期符合新版药典及GMP等相关指导原则。
质量管理是耀海生物的生命线。公司可提供全方位的质量管理服务,坚持以顾客满意为目标,建立“质量为本、完善合规、简单高效、团结协作”的质量方针,致力于提供符合FDA、EMA、NMPA的IND和临床阶段样品制备,及满足NMPA商业化阶段的药品生产全方位质量管理服务。
6. 以客户为中心的项目管理服务
• 公司聚焦以客户为中心的优质CRDMO服务,与客户建立密切合作,匹配专业的项目管理团队一对一服务,严格把控项目重点里程碑及项目风险的识别和管理,全方位满足客户需求。同时高度重视客户知识产权保护,建立严苛、合理的保密机制和保密措施,确保客户项目信息和知识产权安全。