耀海生物,在微生物表达体系领域,拥有丰富的重组蛋白、重组质粒生产服务经验,聚焦大肠杆菌和酵母菌表达体系,依托GMP级生产车间、完善的质量管理体系,严格把控工艺流程,以控制重组生物制品原辅料、中间产物及产物的放行标准,同时保证批间一致性,全面满足国内外法规要求。
公司可提供GMP级重组蛋白生产服务,涵盖50L-100L-200L-500L-1000L-2000L多规模发酵平台,匹配多种规格的低/中/高压层析系统,以及西林瓶水针/冻干、预充式/卡式瓶全自动无菌灌装系统。可为客户提供IND申报样品生产、I-III期临床样品生产、MAH商业化生产服务,全面加速药物开发进程。

耀海CMO平台可服务的重组蛋白制品包括:
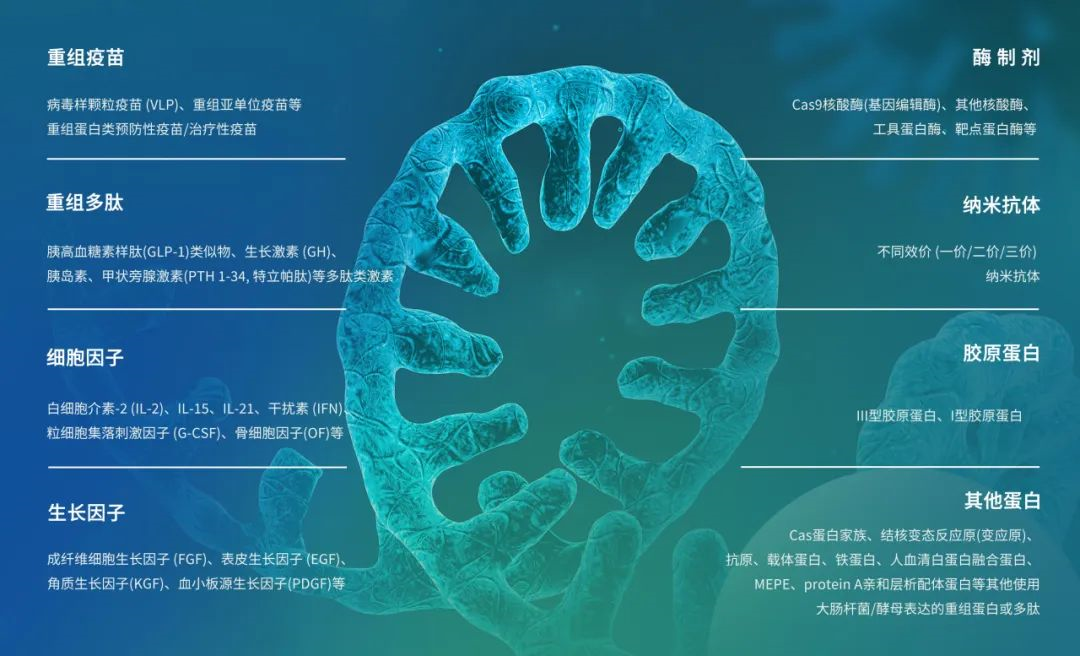
重组蛋白CMO服务详情
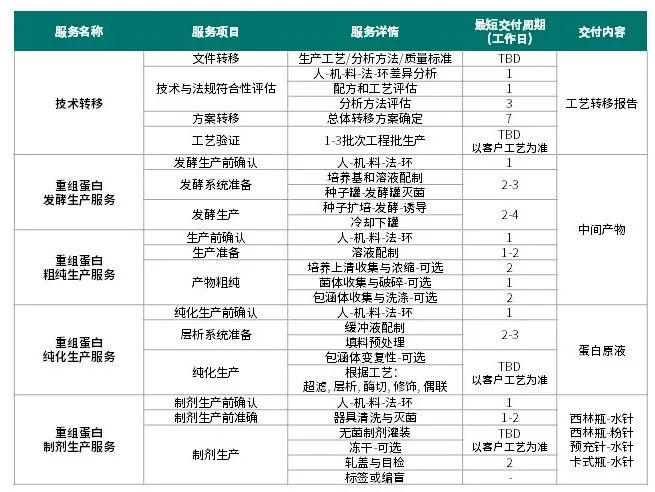
注:所述“重组蛋白”泛指重组蛋白或重组多肽;
TBD: to be determined (以客户工艺为准)。
多个检测项目可同时开展。
重组蛋白原液+制剂CMO项目,耀海平均交付周期为3-5个月(含工程批, 周期供参考),实际交付周期以客户工艺为准。
重组蛋白质量分析与控制服务详情
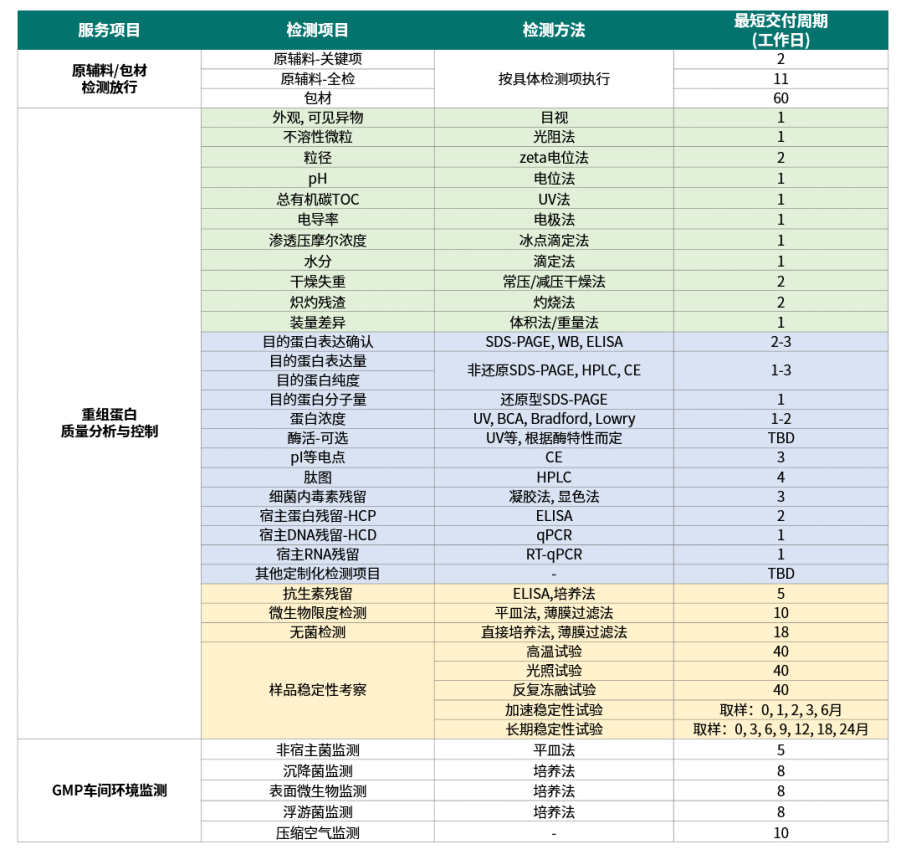
注:所述“重组蛋白”泛指重组蛋白或重组多肽;
TBD: to be determined (以客户工艺为准)。
多个检测项目可同时开展。
重组蛋白原液+制剂CMO项目,耀海平均交付周期为3-5个月(含工程批, 周期供参考),实际交付周期以客户工艺为准。
服务特色
多规模CMO服务平台
原液车间含GMP级50L-100L-200L-500L-1000L-2000L多规模发酵平台,匹配对应规模的离心、高压均质和低压/高压层析设备。
制剂车间含GMP级全自动灌装系统,涵盖1-25mL西林瓶水针(60,000支/批)和粉针(37,800支/批)、1-3mL预充针/卡式瓶(20,000支/批)。
标准的GMP级防爆车间
防爆配液系统均符合防爆要求,车间安装静电释放仪,并配备可燃气体报警装置,可满足反相层析等特殊工艺配液需求。
合规性保障平台
全面评估产品及质量标准的合规性,如宿主来源、抗生素类型、毒性或致敏性,满足注册申报要求。
质量控制与分析服务
国内外新版药典和药品生产指导原则驱动下的质量控制服务,涉及原辅料/包材放行、中间产物放行及产物放行。
丰富的技术转移/放大经验
可针对不同规模的发酵和层析系统,调整转换和放大参数。
截止至目前,已成功交付100+重组蛋白&多肽&质粒CMC项目,其中包括多个IND临床批件,覆盖中美双报及澳洲注册项目。
开放性线上审计平台
开放线上审计端口,共享GMP车间VR视频。