在生物药物研发生产过程中,质量管理与控制是至关重要的一环。
耀海生物秉持以“质量为本、完善合规、简单高效、团结协作”的质量方针为指引,将质量管理视为公司的生命线,建立了符合NMPA、FDA、EMA等法规要求的质量管理体系,并在不断的创新发展过程中,持续完善和提升质量管理体系。坚持以确保产品质量为目标,以客户满意为宗旨,致力于为广大合作伙伴提供符合FDA、EMA、NMPA的IND和临床阶段样品制备,及满足NMPA商业化阶段的药品生产的全方位质量管理服务。
耀海生物拥有符合GMP规范的大规模生物药商业化生产基地,于2012年取得治疗用生物制品的药品生产许可证,并多次通过国家药监局药品注册现场核查和GMP符合性检查。经药监部门审核通过的质量管理体系,贯穿从研发到商业化阶段的全流程。
耀海生物质量管理体系建立原则
・质量体系覆盖药品从研制至商业化生产的全生命周期。
・质量体系基于国内外现行的法律法规,遵循CMC(化学,生产与控制)活动的法律法规要求。
・结合CRDMO业务特点,灵活满足客户对药品委托研究和委托生产的需求。
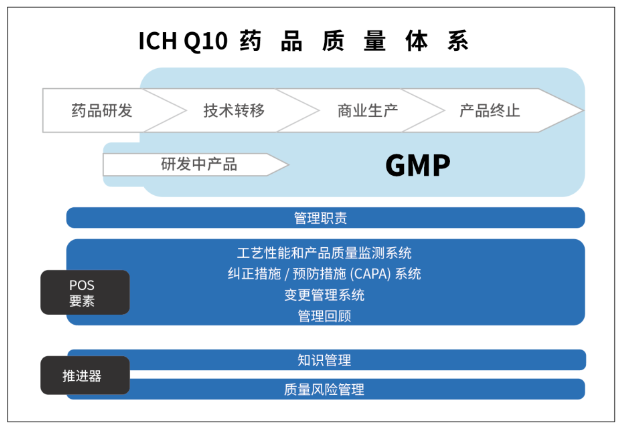
Q10药品全生命周期质量管理
文件保障系统
耀海生物依据GMP相关要求,建立了完备的文件保障系统,同时紧贴公司业务模式,确保公司所有的GMP活动均在文件体系规范下进行,保证生产过程的均一性、可复制性和可追溯性。
耀海生物拥有1500平方米的独立QC实验室,基于自身丰富的GMP质量管理经验,通过质量控制(QC)团队与生产、质量保证团队密切合作,不断提升在生物药原辅料检测、中间过程控制、稳定性研究及产品放行检测等方面服务能力,旨在为客户提供持续稳定的质量服务。同时,建立了完善的质量控制体系,符合各法规要求,质量体系贯穿QC检验各阶段。

目前,公司建立了完善的理化、微生物学、生物化学方面的质量检测平台,可根据产品的不同理化特性,建立了针对不同产品的质量控制方法。凭借丰富的实验室品质管理经验及分析检测能力,匹配行业一流的检测设备,能够满足生物制品(重组蛋白、多肽类、质粒产品等)放行检测要求,支持生物药开发全生命周期的分析与质控需求。
凭借丰富的实践经验和日臻完善的质量管理服务体系,耀海生物已成功赋能两百余个客户项目,赢得客户广泛赞誉,在CRDMO服务行业内坚定了坚实的服务口碑。

未来,耀海生物将继续坚持以客户满意为目标,秉承“质量为本、完善合规、简单高效、团结协作”的质量方针,通过持续的监控、回顾、定期更新来不断完善质量管理体系,以满足客户对商业化生产的高期望,灵活应对客户对临床阶段cGMP合规性的需求,向客户提供卓越的服务和可信赖的产品质量,为药品研发生产保驾护航。