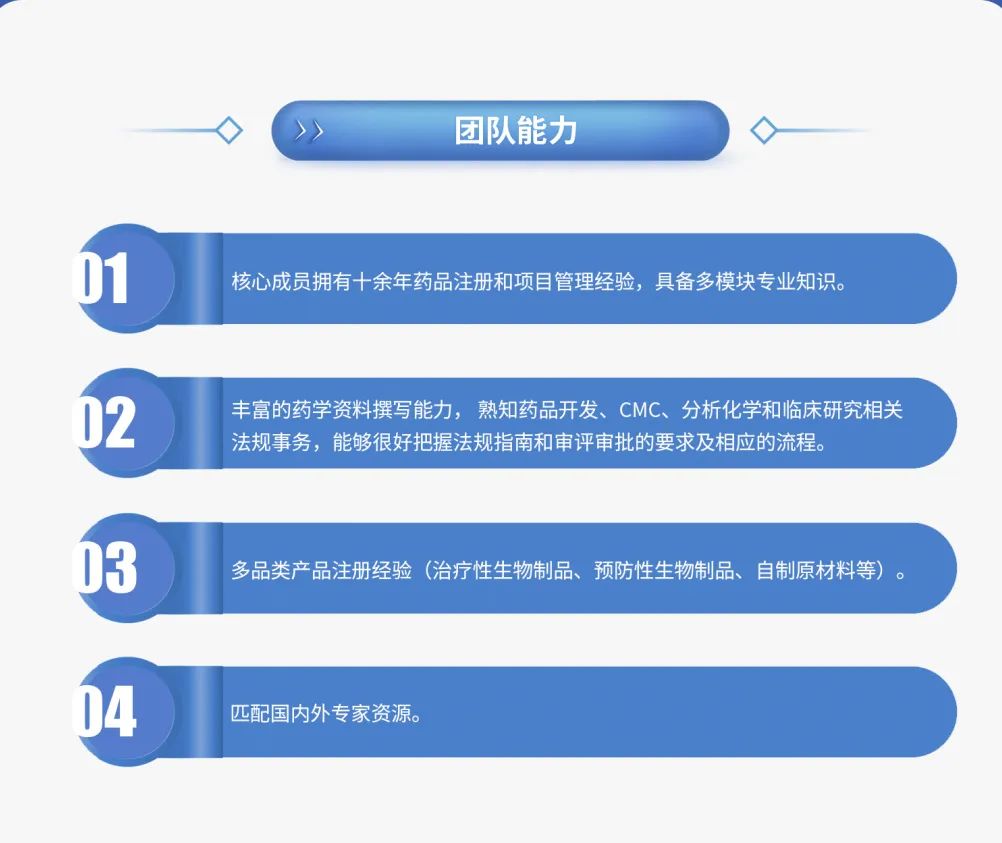
耀海生物拥有丰富经验的药品注册申报服务团队,可提供优质、高效、精准的注册支持,包括国内外IND/BLA等相关注册服务。
公司可为客户提供包括CMC咨询服务、注册申报策略指导、协助完成CMC相关CTD资料撰写提交、协助与官方机构沟通、指导研制现场核查、组织药品注册法规培训及会议指导等全方位的注册法规服务。
公司注册团队核心成员拥有丰富的注册申报经验,对国内外注册相关法规有着深入研究和理解,能够全面地为客户在产品研发的整个生命周期内提供法规策略指导。同时在产品注册过程中,能够充分理解NMPA、FDA、EMA等全球各地监管部门对产品申报资料的具体要求及沟通机制,保证项目快速推进。
服务内容
注册服务
组织机构会议,包括1,2,3类CDE咨询会议和其他会议(包括提交会议请求、准备会议文件和参加会议,协助客户与监管机构有效沟通)
CMC法规咨询服务
国内及国际注册申报CMC策略制定及差距分析指导
协助与监管机构沟通,协助答复审批意见及提交补充资料
协助注册检验相关事宜交流沟通
协助完成注册申报资料整理、审核、申报及递交等工作
注册申报资料撰写
IND、NDA注册申报资料撰写
根据客户需求,提供定制化注册申报资料撰写服务
法规支持矩阵
全球药品监管机构法规调研
法规策略&执行指导
公用法规及个性化法规梳理、解读
一对一法规咨询
现场核查
指导核查资料筹备
指导药品注册现场核查
其他增值及专项服务
项目技术开发或转让过程中的项目论证
药品IND/NDA申报策略梳理
专项品种调研评估
项目管理
平台优势
丰富项目运作经验
服务客户超200家,涵盖多种项目类型,经验丰富。
精准把握法规指南、审评要求及药品注册要点,提前预判项目难点,加速药品注册审批。
实时信息共享
与官方渠道保持友好畅通联系,实时掌握新法规趋势,充分了解监管机构法律法规。
以强大的法规数据库及文件模板数据库,通过充分信息整合和分析,与客户实现实时信息共享。
全生命周期服务管理
以药品全生命周期管理理念,提供从研发体系建立、IND申报、NDA申报至项目管理等一站式服务。
完善的项目管理服务
围绕项目全生命周期提供专业策划指导服务,并提出可行性建议。
紧密结合项目实际情况,制定可落定地解决方案。