稳定性试验研究作为药品在研发、临床、上市及上市后质量研究的重要内容,主要目的是考察药品在温度、湿度、光照等因素的影响下质量随时间变化的趋势,为药品的生产工艺、制剂处方、包装材料、贮藏条件和有效期/复检期的确定提供支持性信息。通过试验建立药品的有效期,以保障用药的安全有效。
同时,稳定性试验研究作为药品质量控制研究的基本内容,与药品标准的建立紧密相关,且具有阶段性特点,贯穿药品研究与开发的全生命周期。

在工艺开发阶段,小试产品的稳定性探索可以为后续中试产品的稳定性研究做预判;在新药注册申报时,需要完成稳定性试验(长期稳定性试验、临床使用稳定性试验、反复冻融稳定性、运输稳定性等),以指导在临床试验阶段试验用药的存储及使用;药品上市后,虽然产品没有发生变化,但每年也必须要做持续稳定性考察。
生物制品稳定性试验一般包括长期稳定性试验、加速稳定性试验、强制试验(也称影响因素试验,属于稳定性试验的探索)。长期稳定性试验一般是在推荐的贮藏条件下进行的,其可以作为制定产品储存条件和有效期的重要依据;加速稳定性试验一般是在长期与强制试验条件之间进行的,其目的在于评估运输和存储过程中条件的短期偏离对产品的影响(包括生物降解或物理变化等);强制试验一般是在更恶劣、更极端的环境下进行,其目的在于评估产品的降解途径、破坏程度,也被用来评价产品杂质(降解产物)分析方法的有效性。
选择经验丰富的合作伙伴进行稳定性检测可有效保证生物制品顺利推进。
Yaohai Bio-Service:稳定性试验研究服务概览
耀海生物搭建了成熟的质量控制服务平台,检测场地为1500㎡的GMP级实验室,凭借丰富的实验室品质管理经验及分析检测能力,累计开发了50+ 检测技术方法,成功服务了近百个生物制品检测项目,能够满足生物制品(重组蛋白、多肽类、质粒产品等)及菌种放行检测要求,支持生物药开发生命周期的分析与质控需求。同时,在检测标准方面,依据中国、美国、欧盟等全球主流制药市场的法规要求和行业共识,建立了全面、高标准的检测体系,目前实验室体系已通过中国GMP、欧盟QP审计。
依托良好的质量管理体系、齐全的质量分析研究设备和丰富的药物研究及申报经验基础,公司致力于为客户提供一站式稳定性研究及申报资料撰写服务。稳定性试验研究服务项目主要包括稳定性方案/报告设计、分析方法转移/验证、样品存储、样品检测、NDA/MAA申报资料撰写等。

同时,也可根据客户项目实际需求,提供系列化定制检测服务,满足客户不同类型项目的检测需求。
定制化服务内容包括但不限于
项目专属稳定性考察方案/报告、分析方法转移/验证、样品运输/存储、样品检测、电子数据备份/灾难恢复、合规流程管理(OOS/OOT/异常/偏差)
稳定性试验研究及考察的相关法规依据
ICH,2003.02.06,Q1A~Q1F Stability
NMPA,2015.02,化学药物(原料药和制剂)稳定性研究技术指导原则
NMPA ,2015.04,生物制品稳定性研究技术指导原则(试行)
中国药典2020版 9001原料药物与制剂稳定性试验指导原则
USP,现行版
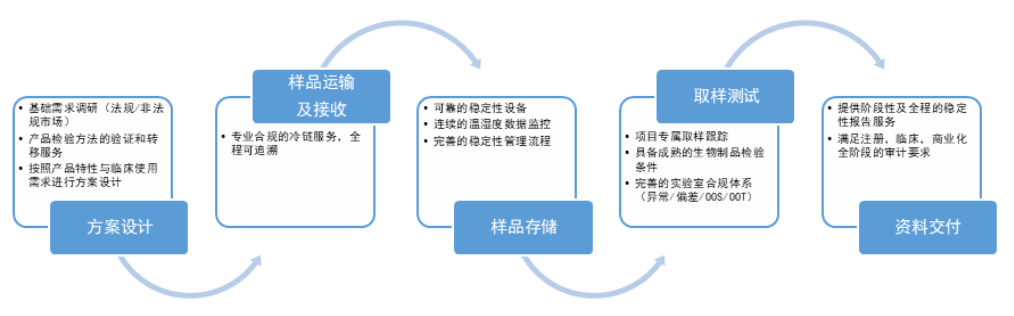
稳定性试验研究项目承接服务流程
服务优势与特色
01先进的实验设施和完善的资质
实验室通过生物安全实验室二级备案,满足无菌、微生物限度等检测需求;
实验室体系已通过中国GMP、欧盟QP审计,可满足各合规要求。
匹配丰富的检测仪器设备配置、技术先进(UPS电源系统、服务器数据备份系统(可实现灾难恢复)、testo温湿度在线管理和实时监控报警系统)。
02专业稳定的服务团队
QC检测服务团队拥有出众的专业技能及丰富的生物制品检测经验,攻关能力强,能够切实为有难度的项目提供有效解决方案。
注册团队核心成员拥有十余年药品注册和项目管理经验,具备多模块专业知识,及丰富的专业运作经验。
03丰富的实战项目经验
已成功服务近百个独立的稳定性考察项目,积累大量客户合作经验,与国内多家知名药企保持长期合作关系,值得信赖。
04成熟的生物制品稳定性研究方案
一站式生物制品稳定性研究方案,涵盖产品分析与评估、稳定性研究计划制定、环境模拟与条件设置、定期检测与数据分析、风险评估与预测及持续监控改进等,确保整体服务方案符合相关法规要求。
05高效的项目服务体系
项目管理经验丰富,项目经理一对一服务,高效协同,加快项目交付周期。
实验室关键设备设施展示